Hemoglobiini (Hb) on rautaa sisältävä metalloproteiini, jota esiintyy runsaasti lähes kaikkien selkärankaisten punasoluissa. Sitä kutsutaan usein "elämää ylläpitäväksi molekyyliksi" sen korvaamattoman roolin vuoksi hengityksessä. Tämä monimutkainen proteiini vastaa kriittisestä tehtävästä kuljettaa happea keuhkoista kaikkiin kehon kudokseen ja helpottaa hiilidioksidin palautumista erittymistä varten. Sen toiminnan, sen toimintaa säätelevien hienostuneiden mekanismien ja sen kliinisen mittaamisen ensiarvoisen merkityksen ymmärtäminen tarjoaa ikkunan ihmisen terveyteen ja sairauksiin.
Toiminta ja mekanismi: Molekyylitekniikan mestariteos
Hemoglobiinin ensisijainen tehtävä on kaasujen kuljetus. Se ei kuitenkaan suorita tätä tehtävää kuten yksinkertainen, passiivinen sieni. Sen tehokkuus perustuu hienostuneeseen rakenteeseen ja dynaamisiin säätelymekanismeihin.
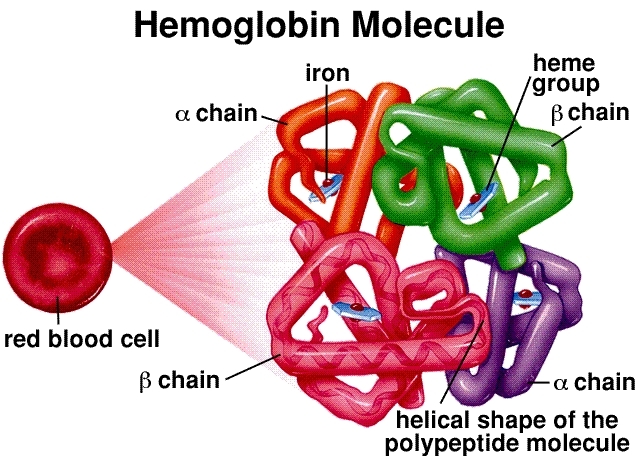
Molekyylirakenne: Hemoglobiini on tetrameeri, joka koostuu neljästä globiiniproteiiniketjusta (kaksi alfaa ja kaksi beetaa aikuisilla). Jokainen ketju liittyy hemiryhmään, monimutkaiseen rengasrakenteeseen, jonka keskellä on rauta-atomi (Fe²⁺). Tämä rauta-atomi on happimolekyylin (O₂) varsinainen sitoutumiskohta. Yksi hemoglobiinimolekyyli voi siis kantaa enintään neljä happimolekyyliä.
Yhteistyökykyinen sitoutuminen ja sigmoidinen käyrä: Tämä on hemoglobiinin tehokkuuden kulmakivi. Kun ensimmäinen happimolekyyli sitoutuu hemiryhmään keuhkoissa (joissa happipitoisuus on korkea), se aiheuttaa konformaatiomuutoksen koko hemoglobiinirakenteessa. Tämä muutos helpottaa seuraavien kahden happimolekyylin sitoutumista. Viimeinen neljäs happimolekyyli sitoutuu helpoimmin. Tämä "yhteistyökykyinen" vuorovaikutus johtaa tyypilliseen sigmoidiseen (S-muotoiseen) hapen dissosiaatiokäyrään. Tämä S-muoto on ratkaiseva – se tarkoittaa, että keuhkojen happirikkaassa ympäristössä hemoglobiini kyllästyy nopeasti, mutta hapettomissa kudoksissa se voi vapauttaa suuren määrän happea vain pienellä paineenlaskulla.
Allosteerinen säätely: Hemoglobiinin affiniteetti happeen ei ole kiinteä; se on hienosäädetty kudosten aineenvaihduntatarpeiden mukaan. Tämä saavutetaan allosteeristen efektorien kautta:
Bohrin vaikutus: Aktiivisissa kudoksissa voimakas aineenvaihdunta tuottaa hiilidioksidia (CO₂) ja happoa (H⁺-ioneja). Hemoglobiini aistii tämän kemiallisen ympäristön ja reagoi vähentämällä happeen sitoutumistaan, mikä johtaa O₂:n vapautumiseen enemmän juuri siellä, missä sitä eniten tarvitaan.
2,3-bisfosfoglyseraatti (2,3-BPG): Tämä punasoluissa tuotettu yhdiste sitoutuu hemoglobiiniin ja stabiloi sen hapetonta tilaa, mikä edistää entisestään hapen vapautumista. 2,3-BPG:n pitoisuudet nousevat kroonisissa hapettomissa tiloissa, kuten korkealla merenpinnasta, mikä parantaa hapen kulkeutumista.
Hiilidioksidin kuljetus: Hemoglobiinilla on myös tärkeä rooli CO₂:n kuljetuksessa. Pieni mutta merkittävä osa CO₂:sta sitoutuu suoraan globiiniketjuihin muodostaen karbaminohemoglobiinia. Lisäksi puskuroimalla H⁺-ioneja hemoglobiini helpottaa suurimman osan CO₂:sta kuljetusta bikarbonaattina (HCO₃⁻) plasmassa.
Hemoglobiinitestauksen kriittinen merkitys
Hemoglobiinin keskeisen roolin vuoksi sen pitoisuuden mittaaminen ja laadun arviointi on modernin lääketieteen peruspilari. Hemoglobiinitesti, joka on usein osa täydellistä verenkuvaa (CBC), on yksi yleisimmin tilatuista kliinisistä tutkimuksista. Sen merkitystä ei voida yliarvioida seuraavista syistä:
Taudin etenemisen seuranta ja hoito:
Anemiapotilaille säännölliset hemoglobiinimittaukset ovat välttämättömiä hoidon, kuten rautalisän, tehokkuuden seuraamiseksi ja taustalla olevien kroonisten sairauksien, kuten munuaisten vajaatoiminnan tai syövän, etenemisen seuraamiseksi.
Hemoglobinopatioiden havaitseminen:
Erikoistuneita hemoglobiinitestejä, kuten hemoglobiinielektroforeesia, käytetään diagnosoimaan perinnöllisiä geneettisiä sairauksia, jotka vaikuttavat hemoglobiinin rakenteeseen tai tuotantoon. Yleisimpiä esimerkkejä ovat sirppisoluanemia (viallisen HbS-variantin aiheuttama) ja talassemia. Varhainen havaitseminen on elintärkeää hoidon ja geneettisen neuvonnan kannalta.
Polykytemian arviointi:
Epänormaalin korkea hemoglobiinitaso voi viitata polykytemiaan, tilaan, jossa elimistö tuottaa liikaa punasoluja. Tämä voi olla primaarinen luuytimen sairaus tai toissijainen reaktio krooniseen hypoksiaan (esim. keuhkosairaudessa tai korkealla merenpinnasta), ja siihen liittyy tromboosiriski.
Seulonta ja yleinen terveydentilan arviointi: Hemoglobiinin testaus on rutiininomainen osa synnytystä edeltävää hoitoa, leikkausta edeltäviä tarkastuksia ja yleisiä terveystarkastuksia. Se toimii laajana indikaattorina yleisestä terveydentilasta ja ravitsemustilasta.
Diabeteksen hallinta: Vaikka glykoituneen hemoglobiinin (HbA1c) testi ei olekaan hemoglobiinin standardi, se mittaa, kuinka paljon glukoosia on kiinnittynyt hemoglobiiniin. Se heijastaa keskimääräisiä verensokeritasoja viimeisten 2–3 kuukauden ajalta ja on kultainen standardi pitkäaikaiseen glykeemisen kontrolliin diabeetikoilla.
Johtopäätös
Hemoglobiini on paljon enemmän kuin pelkkä hapenkuljettaja. Se on hienostuneesti suunniteltu molekyylikone, joka hyödyntää yhteistoiminnallista sitoutumista ja allosteerista säätelyä optimoidakseen hapen kulkeutumisen vastauksena kehon dynaamisiin tarpeisiin. Näin ollen hemoglobiinin kliininen mittaus ei ole vain numero laboratorioraportissa; se on tehokas ja ei-invasiivinen diagnostiikka- ja seurantatyökalu. Se tarjoaa korvaamattoman tilannekuvan henkilön hematologisesta ja yleisestä terveydentilasta, mahdollistaen elämää muuttavien tilojen diagnosoinnin, kroonisten sairauksien seurannan ja kansanterveyden ylläpitämisen. Sekä sen biologisen nerouden että kliinisen merkityksen ymmärtäminen korostaa, miksi tämä vaatimaton proteiini on edelleen fysiologisen ja lääketieteen kulmakivi.
Julkaisuaika: 17.10.2025